
2022下半年值得关注的临床试验
RNAi疗法治疗常见疾病的未来
6 月 13 日,Alnylam 宣布,FDA 批准该公司 RNAi 疗法 Amvuttra(vutrisiran)上市,用于治疗成人遗传性转甲状腺素蛋白介导(hATTR)的淀粉样变性多发性神经病变。这是 FDA 批准的首款只需每 3 个月皮下注射一次,就能够逆转神经病变损伤的RNAi 疗法。Vutrisiran 也是 Alnylam 获批的第 4 款 RNAi 疗法。此前其开发的首款 RNAi 疗法patisiran 于 2018 年获 FDA 批准上市,用于治疗 hATTR 淀粉样变性多发性神经病变。
今年下半年,Alnylam靶向降解淀粉样蛋白前体(APP)的RNAi疗法ALN-APP有望报告初步临床试验结果。这款疗法使用了靶向中枢神经系统的偶联递送技术,是首款靶向APP的RNAi疗法,用于治疗阿尔茨海默病。该公司用于治疗非酒精性脂肪肝(NASH)的RNAi疗法ALN-HSD也将报告初步临床试验结果。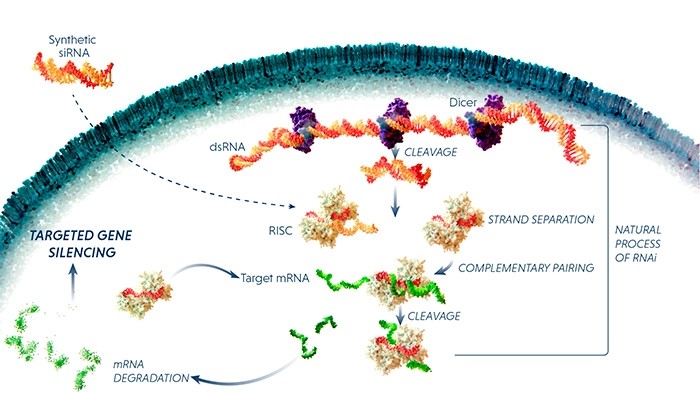
不仅仅是RNAi,目前小核酸药物已经初露锋芒,正在扮演越来越重要的角色。小核酸药物主要包括反义寡核苷酸(ASO)、小干扰RNA(siRNA)、微小RNA(miRNA)、小激活RNA(saRNA)、mRNA、RNA适配体等,其中siRNA、miRNA、saRNA属于RNAi药物。相比起抗体药,核酸药物在研发阶段不需要进行复杂蛋白修饰和CMC开发(工艺和质量控制),生产阶段制备工艺相对简单,不需要大规模哺乳动物细胞发酵和蛋白纯化,具有候选靶点丰富、研发周期短、药效持久、临床开发成功率高等优势。小核酸药物从转录后水平进行治疗,能针对难以成药的特殊蛋白靶点实现突破,有望攻克尚无药物治疗的疾病;具备针对“不可靶向”、“不可成药”疾病开发出治疗药物的巨大潜力。可以说,小核酸药物已经形成继小分子药物、抗体药物之后的现代新药第三次浪潮。
为了满足寡核苷酸药物的研发需求,汇智泰康凭借多年来在生物医药研发、生物安全评价和分析检测领域积累的技术、方法和项目经验,开发了针对寡核苷酸药物的血浆蛋白结合试验方法,构建了寡核苷酸药物的服务平台体系,可以为寡核苷酸药物提供临床前及临床检测等相关服务
插入 汇智泰康寡核苷酸药物分析评价实验平台 的软文链接
阿尔茨海默病的新浪潮
阿尔茨海默病(Alzheimer's disease, AD)是一种隐匿起病的进行性脑部疾病,通常表现为遗忘性认知障碍,患者日常生活能力、社会交往能力等明显减退,高发于65岁以上人群。目前治疗AD的一线药物包括胆碱酯酶抑制剂(多奈哌齐、卡巴拉汀等)和兴奋性氨基酸受体拮抗剂(盐酸美金刚),但这些药物仅能延缓并不能逆转或阻止AD进展。
2021年6月,由Biogen公司研发的以Aducanumab为活性成分的药物AduhelmTM获美国FDA加速批准上市,用于治疗AD,为逆转AD的病理进程提供了可能性。这一成果无疑加速了阿尔兹海默病药物研发这一领域的行业进程。
今年下半年,三款靶向β淀粉样蛋白的单克隆抗体疗法有望公布3期临床试验结果。分别是礼来(Eli Lilly and Company)公司的donanemab、罗氏旗下基因泰克公司的抗β淀粉样蛋白抗体疗法gantenerumab以及渤健和卫材研发的另一款阿尔茨海默病抗体疗法lecanemab。其中,礼来(Eli Lilly and Company)公司的donanemab已经在2期临床试验中达到主要终点,将早期阿尔茨海默病患者的临床进展速度延缓32%。渤健和卫材研发的另一款阿尔茨海默病抗体疗法lecanemab已完成向FDA滚动递交上市申请,这款疗法也有望在今年9月获得3期临床数据。而罗氏则处于一个“悲喜交加”的状态,6月16日,罗氏和班纳老年痴呆症研究所联合宣布,anti-β淀粉样蛋白的特异性单克隆抗体药物crenezumab(克雷内治单抗)在阿尔茨海默症预防倡议(API)项目中的II期临床未达到主要研究终点,但罗氏也收获了全球首个CD3/CD20双抗的监管批准。不过,罗氏还在开展Aβ单抗gantenerumab针对阿尔茨海默症的临床试验,最新III期研究结果预计在2022年第4季度公布。
CRISPR基因编辑疗法展现“治愈”潜力
今年6月份,Vertex Pharmaceuticals和CRISPR Therapeutics公司公布了基于CRISPR/Cas9的基因编辑疗法CTX001,治疗输血依赖型β地中海贫血(TDT)或严重镰刀型细胞贫血病(SCD)患者的最新临床试验结果。新闻稿指出,从总计75名患者中获得的结果显示,CTX001具有一次治疗,提供功能性治愈的潜力。
CTX001是一种研究性、自体性、CRISPR/Cas9基因编辑的造血干细胞疗法,预计用于治疗输血依赖性β地中海贫血(TDT)和重度镰状细胞病(SCD)。在这种疗法中,患者的造血干细胞被改造成在红血球中产生高水平的胎儿血红蛋白(HbF;血红蛋白F)。HbF是一种携带氧气的血红蛋白,在出生时自然存在,然后转换为成人形式的血红蛋白。CTX001升高HbF有潜力减轻TDT患者的输血需求、减少SCD患者痛苦且使人虚弱的镰状细胞危象。值得一提的是,CTX001是治疗TDT和SCD方面临床推进最快的基因编辑方法,同时也是第一个在临床上已被证明概念正确的CRISPR/Cas9治疗方法。
Vertex Pharmaceuticals和CRISPR Therapeutics同时表示,临床试验已经完成所有患者注册,试验进度支持年底前递交监管申请。对于CRISPR基因编辑技术,这可能成为又一项重大突破。

新一代减肥疗法整装待发
司美格鲁肽是一种胰高血糖素样肽-1(GLP-1)类似物,与天然人GLP-1有94%的结构同源性。GLP-1是一种由30个氨基酸组成的肠促胰岛素激素,餐后由回肠远端、结肠近端和迷走神经的L细胞分泌,具有降糖和减重的作用。司美格鲁肽可通过减少食欲和饥饿感、减少能量摄入、增加饱腹感、改变食物偏好、延缓胃排空等机制起到减重的作用。
2021年6月4日,诺和诺德(Novo Nordisk)公司开发的Wegovy(semaglutide,司美格鲁肽)注射液获得美国FDA批准,成为2014年以来美国FDA批准的首款用于治疗普通肥胖症或超重的新药。目前,该公司正在探索多种更有效的减肥疗法。其中,长效胰淀素(amylin)类似物cagrilintide与司美格鲁肽联用,治疗2型糖尿病的2期临床试验将在第三季度报告结果。在为期20周的1期临床试验中,剂量为2.4毫克的cagrilintide与司美格鲁肽联用,将患者体重降低17%,优于司美格鲁肽单药的表现。诺和诺德将在今年下半年启动3期临床试验,检验这一减肥组合的效果。
虽然早在2021年司美格鲁肽就已经通过美国FDA审批,可以用于治疗普通肥胖症或超重,但在国内还尚未批准。尽管如此,已经有部分人群将这种药物用于减肥。7月13日晚,华东医药公告称,全资子公司杭州中美华东制药有限公司(以下简称中美华东)收到国家药品监督管理局签发的《受理通知书》,由中美华东申报的利拉鲁肽注射液用于肥胖或超重适应症的上市许可申请获得受理。国内首个GLP-1受体激动剂药物的体重控制适应症或将由华东医药摘得。

预防儿童肺炎球菌感染的新选择
2021年6月11日辉瑞公司(Pfizer)宣布,美国FDA已批准Prevnar 20(肺炎球菌20价结合疫苗)用于18岁及以上成人,预防由疫苗中20种肺炎球菌血清型引起的侵袭性疾病和肺炎。这是预防导致大多数侵袭性疾病和肺炎的20种肺炎球菌血清型结合疫苗的首次获批,包含了导致美国40%肺炎球菌疾病病例和死亡的7种血清型。在今年1月份,辉瑞还公布了3期临床研究(B7471026)的阳性顶线结果,结果显示:Prevnar 20可与新冠mRNA疫苗同时接种。然而儿童患者是肺炎球菌感染的主要人群之一,2022年第三季度,辉瑞在儿童群体中进行的3项全球性临床试验将汇报结果。如果结果积极,将有望拓展Prevnar 20在儿童群体中的应用。
参考文献:
- 张芳,刘杰,孙韬华,陈安进,石杰.首个靶向β-淀粉样蛋白的阿尔茨海默病药物aducanumab[J].中国新药杂志,2022,31(10):929-932.
- 贺静,吴柳娇.CRISPR/Cas9在β-地中海贫血治疗中的研究进展[J].昆明理工大学学报(自然科学版):1-7.
- 韩美芬,赵彬,陈伟,刘晓军,杨长青.司美格鲁肽在治疗肥胖症中的作用机制及临床应用进展[J].中国新药杂志,2022,31(09):859-862.
- 陈有海,杨海涛.核酸药物的研发现状与应用前景展望[J].药学进展,2022,46(05):321-324.


